近日,我校生命科學學院李曉驕陽教授團隊在Acta Pharmaceutica Sinica B與Clinical and Molecular Hepatology發表系列中醫藥修復肝血竇內皮微環境、改善肝缺血再灌注損傷的基礎研究新成果,并系統論述了肝竇內皮細胞(LSEC)在肝纖維化病理生理學中的復雜作用。李曉驕陽教授為以上多篇文章的唯一通訊作者,生命科學學院曲姣蓉講師、賈可欣博士、汪樂博士分別為文章的第一作者,生命科學學院為唯一通訊單位。
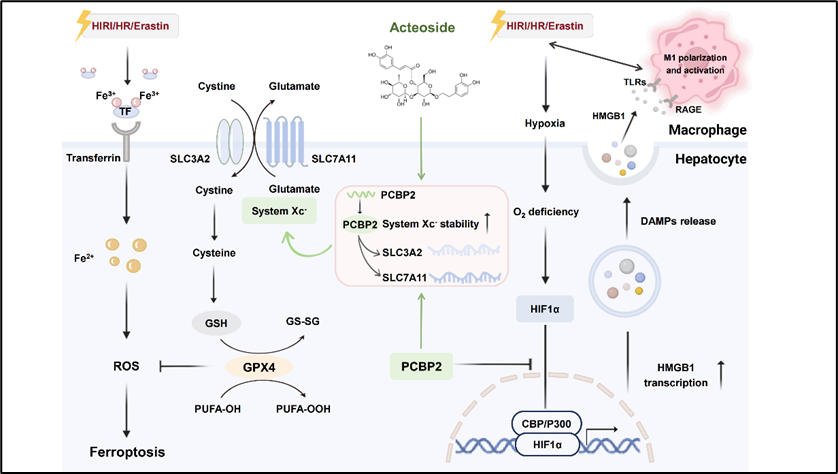
基于肝移植過程中基礎性的肝臟缺血再灌注損傷(HIRI),受啟于肝細胞鐵死亡過程中SLC家族氨基酸跨膜家族蛋白SLC7A11和SLC3A2(構成轉運系統Xc-)穩定性受損,李曉驕陽課題組發現中藥熟地黃有效成分毛蕊花糖苷(ACT)可通過調節聚(rC)結合蛋白2(PCBP2)恢復SLCs跨膜轉運系統的mRNA穩定性,同時干預組蛋白乙酰轉移酶家族因子p300激活缺氧誘導因子HIF1α轉錄活性,以此降低炎性預警蛋白HMGB1的表達和分泌,進而抑制HIRI進程中肝臟微小單元的巨噬細胞募集和免疫環境惡化。此外,通過進一步構建肝細胞靶向PCBP2沉默的小鼠模型,證實了ACT對HIRI的治療效果依賴于PCBP2維持轉運系統Xc-的穩定性和限制HIF1α/P300-HMGB1改善免疫微環境來減輕HIRI進程中的肝細胞鐵死亡發生。該研究首次揭示了RNA結合蛋白PCBP2對鐵死亡明星轉運系統Xc-雙蛋白SLC7A11和SLC3A2的結合和穩定維持作用,創新性地借助多蛋白互作及分子垂釣手段證實了肝細胞鐵死亡進程中的免疫微環境變化,并驗證了天然中藥成分ACT對肝臟缺血再灌注的治療效果(Xiaojiaoyang Li et al., APSB, 2024)。
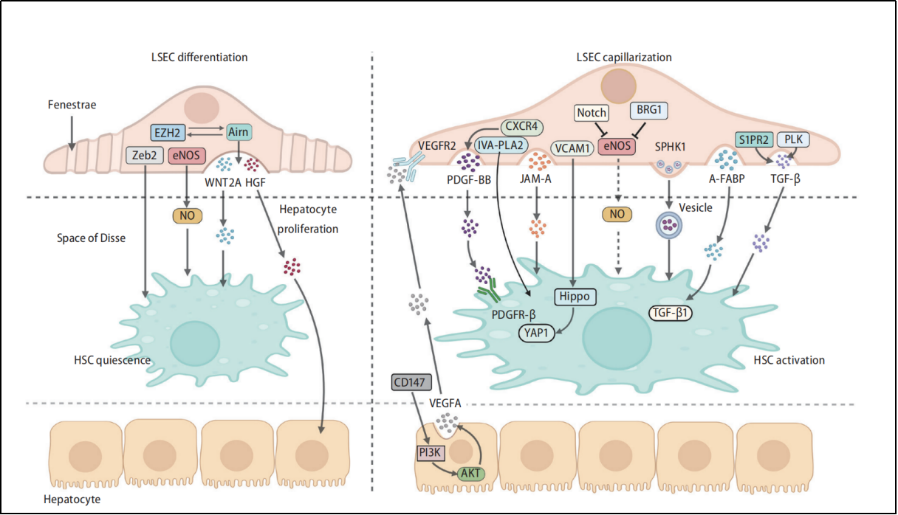
在肝缺血再灌注損傷和肝纖維化等病理過程中,LSEC作為肝臟內部血管系統的組成部分,由于其位于血液與其他肝細胞之間的交界的特殊位置,負責調節物質交換,具有重要的生理功能。另一項研究重點關注了LSEC在肝纖維化中的病理改變。首先總結了LSEC在肝纖維化中的去分化過程,包括毛細血管化、窗孔消失和細胞表型轉變等。在慢性肝損傷中,LSEC去分化不僅改變了其自身特性,還影響了與肝內其它細胞之間的交流,推動了肝纖維化的進程。其次深入探討了LSEC內部穩態和血管分泌信號的調節機制,并發現LSEC的物理和化學特性改變導致其與多種細胞類型之間的正常溝通受損。通過對各種包括中醫藥在內的抗纖維化藥物干預效果和最新調控機制進行系統總結和討論,研究為LSEC在肝纖維化病理生理學中的復雜作用提供了深入見解(Xiaojiaoyang Li et al., Clin Mol Hepatol, 2024)。該研究發表后得到耶魯大學Yasuko Iwakiri教授的高度肯定,并發表題為“Unlocking the Role of Liver Sinusoidal Endothelial Cells: Key Players in Liver Fibrosis”的社論,全面論述了LSEC的結構變化,包括窗孔和毛細血管化、一氧化氮依賴的LSEC與肝星狀細胞(HSC)通訊、LSEC的清除能力以及異質性(Yasuko Iwakiri, Clin Mol Hepatol, 2024)。受Clinical And Molecular Hepatology雜志邀請,課題組再次對該社論做出題為“Correspondence on Letter regarding ‘Liver Sinusoidal Endothelial Cell: An Important Yet Often Overlooked Player in the Liver Fibrosis’”的回應,進一步探討了尋找LSEC及其窗孔的特異性標志物對于揭示LSEC的復雜生理病理學的意義,揭示了LSEC對靶向療法的開發具有巨大的應用前景,以及中藥抑制肝纖維化病理性血管生成的潛力(Xiaojiaoyang Li et al., Clin Mol Hepatol, 2024)。

以上研究是課題組在前期發現ACT可改善HIRI過程中的肝血竇內皮細胞衰老(Xiaojiaoyang Li et al., Int J Biol Sci, 2023)的基礎上的延續和深入,有助闡釋傳統中醫理論下的中藥物質基礎和科學內涵。該項目得到了國家中醫藥現代化重點研發計劃項目(NO. 2022YFC3502100)、國家高層次人才專項支持計劃、中央高校基本科研業務費專項(Grant NO. 2023-JYB-JBZD-046)、國家中醫藥管理局-北京中醫藥大學高水平中醫藥重點學科建設項目(NO. zyyzdxk-2023264)的支持。
