近日,北京中醫藥大學東方醫院胡凱文、周天團隊和中國科學院理化技術研究所低溫科學與技術全國重點實驗室饒偉團隊聯合在Chemical Engineering Journal上以“Autologous Nanovaccine Repolarizes Tumor-Associated Macrophages to M1 Phenotype Inducing PANoptosis for Lung Cancer Immunotherapy”為題,在線發表了成功研發主動靶向巨噬細胞的治療性黃芪多糖自體腫瘤納米疫苗的研究論文(IF=13.4,中科院1區TOP ,JCR 1區),再次展示了醫工結合、中西醫結合治療癌癥的應用潛力。該研究基于中醫 “扶正祛邪”經典理論,從全新角度詮釋了在癌癥治療領域“扶正以祛邪”的現代內涵。該研究得到了國家自然科學基金面上項目資助。

治療性癌癥疫苗是國際腫瘤領域研發新前沿,但其開發思路遭遇了瓶頸。如何無創獲取腫瘤抗原并高效利用、如何避免人為篩選偏差、如何應對腫瘤免疫抑制微環境、如何解決研發成本高昂等,都是“卡脖子”問題。研究團隊從對中醫“扶正祛邪”理論的深入思考中獲得了啟發。
該聯合團隊長期從事納米腫瘤疫苗的相關研究,曾成功研發冷/熱誘導、光電響應等自體腫瘤納米疫苗的系列抗癌新策略。在此最新工作中,該團隊巧妙利用巨噬細胞的“多面手”功能,橋接先天免疫與適應性免疫,同時結合中藥免疫佐劑效用,設計出一種全新的巨噬細胞靶向型自體腫瘤納米疫苗,該方法是團隊此前多項成果(Materials Horizons. 2023;10(5):1661-77;ACS Nano. 2023;17(14):13278-95;Scientific Reports. 2023;13(1):17956)的“2.0”版,無需聯合局部治療(微創消融等)即可實現對腫瘤的有效破壞,同時有效激活機體特異性抗腫瘤免疫,進而實現對體內該種腫瘤細胞的系統性殺傷。
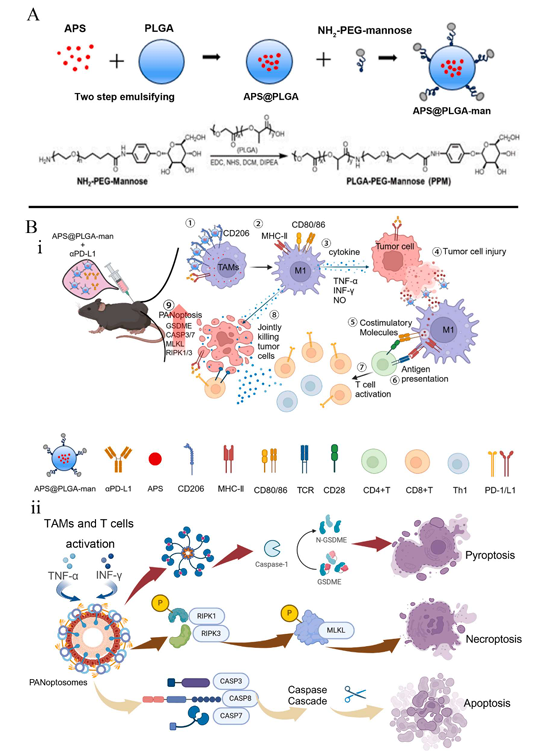
該創新方法通過巧妙的設計思路,將黃芪多糖封裝于納米載體中,顯著增強了APS在體內外的穩定性,同時通過表面修飾賦予其對TAMs的主動靶向能力(APM)。由于該納米顆粒具有pH敏感性,在TAMs攝取后,可在細胞內環境中促進APS釋放,加速M1型極化過程。這一設計不僅確保了藥物安全性,還廣泛促進了TAMs的M1型極化以殺傷腫瘤細胞,同時富集腫瘤相關抗原,尤其是具有強大免疫原性的DAPMs和新抗原,顯著增強巨噬細胞的抗原呈遞能力,激活CD8+T細胞和Th1細胞。由此產生豐富的多樣性細胞因子可誘導腫瘤細胞發生不可逆PANoptosis,進一步釋放大量腫瘤抗原,形成正反饋環路,觸發強大且持久的抗癌效應,最終獲得顯著的抑瘤效應和生存獲益。與免疫檢查點抑制劑聯用可取得良好的協同增效作用。
在雙側肺癌腫瘤模型中,APM和APM+αPD-L1分別使原發腫瘤體積縮小了2.54倍和8.57倍,使遠端腫瘤體積縮小了9.03倍和22倍;APM還可以顯著延長小鼠的生存時間。流式細胞術結果表明經APM和APM+αPD-L1治療的小鼠M1型TAMs比例顯著增加至25.33 ± 0.808%和44.03 ± 13.86%,TNF-α、IFN-γ和IL-6的濃度增加,遠端腫瘤中的CD8+T細胞,脾臟Th1和CD8+T細胞比例較其他組顯著增加。此外,ELIspot、免疫組織化學、TCR測序表明APM治療后的小鼠較對照組腫瘤特異性免疫增強。分子機制相關實驗結果證實了經該療法治療后,小鼠原發腫瘤內抗腫瘤免疫和PANoptosis的核心指標被顯著激活。經生物安全性評估,該策略具有良好的生物相容性和安全性,是一種極具前景的癌癥治療新策略。
北京中醫藥大學東方醫院(第二臨床醫學院)張弛為本論文第一作者,北京中醫藥大學東方醫院胡凱文、中國科學院理化技術研究所低溫科學與技術全國重點實驗室饒偉和北京中醫藥大學東方醫院周天為本論文共同通訊作者。
